エンド-α-N-アセチルガラクトサミニダーゼ (EngBF)
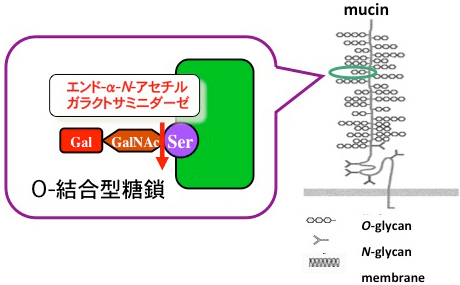
腸管の細胞表面はムチンと呼ばれる粘性を持つ糖タンパク質で覆われており、組織を保護する役割を担っている。そのムチンは常に新しく作られて分泌されているため、腸内細菌にとっては安定的に供給されるエサでもある。ポスドクとしてご指導頂きました山本憲二先生の研究室にて、Bifidobacterium longumがムチン型糖鎖(Galβ1,3GalNAc)を特異的に切断するエンドα-N-アセチルガラクトサミニダーゼをクローニングすることができた。その後、Galβ1,3GalNAc(GNB)がヒトミルク由来のGalβ1,3lcNAc(LNB)と同じLNB/GNB代謝経路で代謝されることが食総研の北岡先生らのグループにより明らかにされた(農研機構)。また、結晶構造は東京大学の伏信先生らのグループにより解析された(PDB、J-STAGE)。B. longumは草食でもあり肉食でもある。利用できる糖はなんでも利用するしたたかさが勢力争いの激しい大腸内で生き抜く鍵を握っているのであろう。
【原著論文】
- Fujita, K., Oura, F., Nagamine, N., Katayama, T., Hiratake, J., Sakata, K., Kumagai, H., and Yamamoto, K.: Identification and molecular cloning of a novel glycoside hydrolase family of core 1 type O-glycan-specific endo-α-N-acetylgalactosaminidase from Bifidobacterium longum. J. Biol. Chem., 280, 37415-37422 (2005).pubmed JBC GH101 CaZYpedia BLLJ_0168 GenBank genome PDB
腸管粘膜に存在するムチンからムチン型糖鎖(Galβ1,3GalNAc)を特異的に切断するエンドα-N-アセチルガラクトサミニダーゼをビフィズス菌から発見し、そのクローニングと大腸菌での発現に成功。
- Ashida, H., Ozawa, H., Fujita, K., Suzuki, S., and Yamamoto, K.: Syntheses of mucin-type O-glycopeptides and oligosaccharides using transglycosylation and reverse-hydrolysis activities of Bifidobacterium endo-α-N-acetylgalactosaminidase. Glycoconj. J., 27, 125-132 (2010). pubmed
Bifidobacterium longum由来のコア-1型のO-結合型糖タンパク質糖鎖を特異的に切断する endo-α-N-acetylgalactosaminidaseの糖転移反応と逆反応を用いて、ムチン型糖ペプチドとオリゴ糖の合成を行った。
【総説•著書】
- 藤田清貴、山本憲二:酵素的切断法・(2)O-グリコシド結合の酵素分解、「糖質II糖タンパク質実験法」生物薬科学実験講座4卷・川嵜敏祐編・廣川書店、43-46 (2011). e-hon
- Katayama, T., Wada, J., Fujita, K., Kiyohara, M., Ashida, H., and Yamamoto, K.: Functions of Novel Glycosidases Isolated from Bifidobacteria. J. Appl. Glycosci., 55, 101-109 (2008). J-STAGE
- Katayama, T., Fujita, K., and Yamamoto, K. : Novel bifidobacterial glycosidases acting on sugar chains of mucin glycoproteins. J. Biosci. Bioeng., 99, 457-465 (2005). pubmed
 ビフィズス菌が持つ糖タンパク質糖鎖分解酵素の解析
藤田清貴/ 応用糖質化学研究室
ビフィズス菌が持つ糖タンパク質糖鎖分解酵素の解析
藤田清貴/ 応用糖質化学研究室
